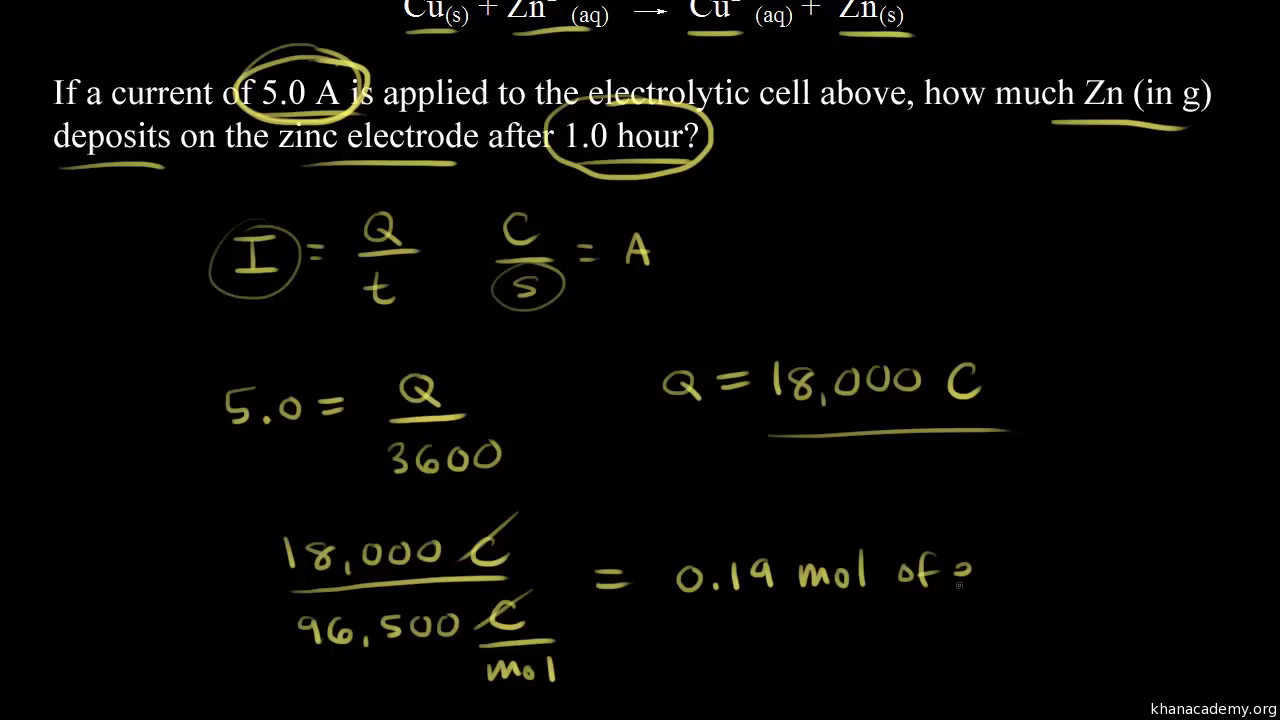Fine Beautiful Electrolytic Cell Khan Academy

Shows the flow of electrons and ions and explains the role.
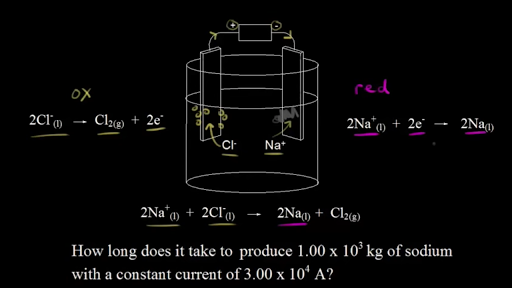
Electrolytic cell khan academy. Aqui eu tenho um diagrama onde eu tenho simplificado eletrólise do coreto de sódio fundido se você derreter o coreto de sódio sólido você terá o coreto de sódio fundido então você terá e hoje só do líquido e um decoro líquido e é isso que nós temos aqui lembre se que numa sandro eletrolítica o terminal negativo da bateria ele entregue elétrons e nesse caso e aqui nesse caso. Ако стопим твърд натриев хлорид получаваме стопен натриев хлорид. Shorthand notation for galvanicvoltaic cells Our mission is to provide a free world-class education to anyone anywhere.
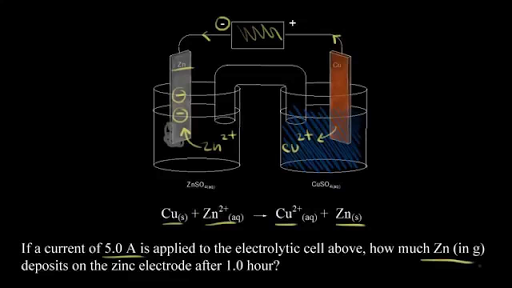
Получаваме натриеви йони и. Не се притеснявай можеш да го изтеглиш и да го. Ainda temos aqui aquela célula eletrolítica que falamos no vídeo anterior então lembre-se uma célula eletrolítica usa uma corrente para produzir uma reação redox não espontânea então precisamos de uma fonte de tensão externa para isso e por isso que temos aqui a nossa bateria sabemos que elétrons do terminal negativo da bateria e nesse caso eles são forçados sobre o eletrodo de.
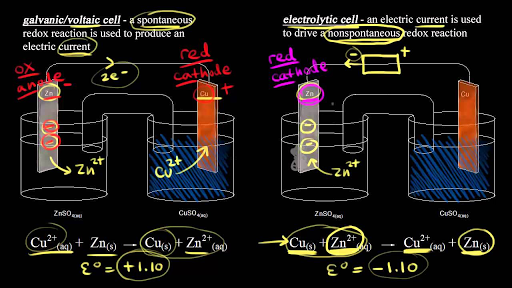
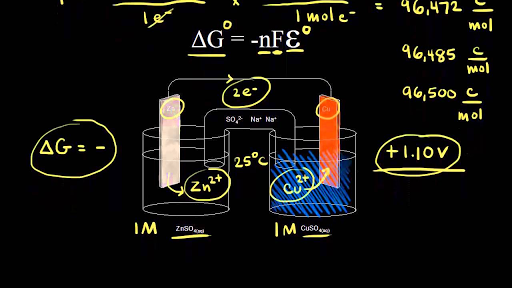
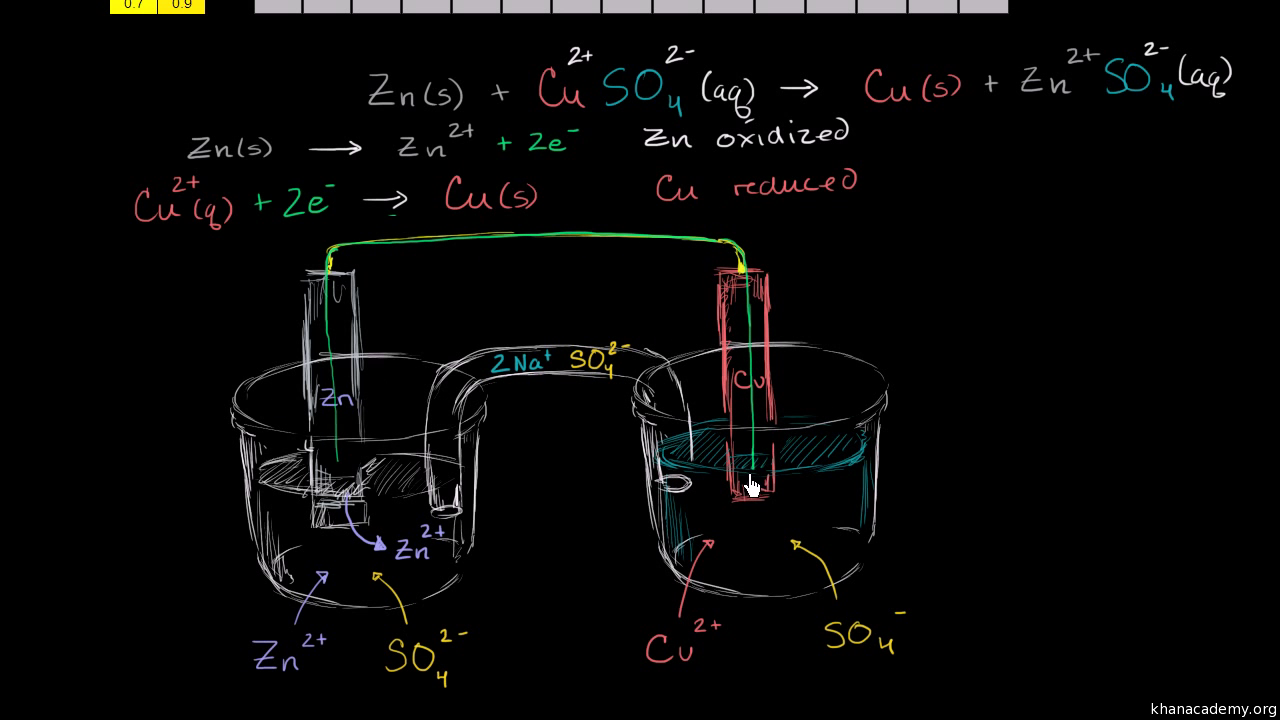
Електролизната клетка използва електричество за да се проведе неспонтанна окислително-редукционна реакция. Това е опростена диаграма на електролиза на стопен натриев хлорид. Before we get into electrolysis lets review the structure of a voltaic cell so we can compare it to an electrolytic cell so a voltaic cell uses a spontaneous redox reaction to produce an electric current so if we start at our zinc electrode solid zinc turns into zinc two plus ions so solid zinc turns into zinc two plus ions and an atom of zinc would have to lose two electrons to turn into.
Khan Academy is a 501c3 nonprofit organization. Lets see the steps of electrolytic refining.
Watch the next lesson. Ако погледнем тук общото уравнение започваме с. Heres the electrolytic cell we talked about in the previous video remember an electrolytic cell uses current to drive a non spontaneous redox reaction so we need an external voltage source and so heres our battery we know what electrons come from the negative terminal of the battery and electrons are forced onto the zinc electrode we know there are zinc two-plus ions in solution so if zinc.
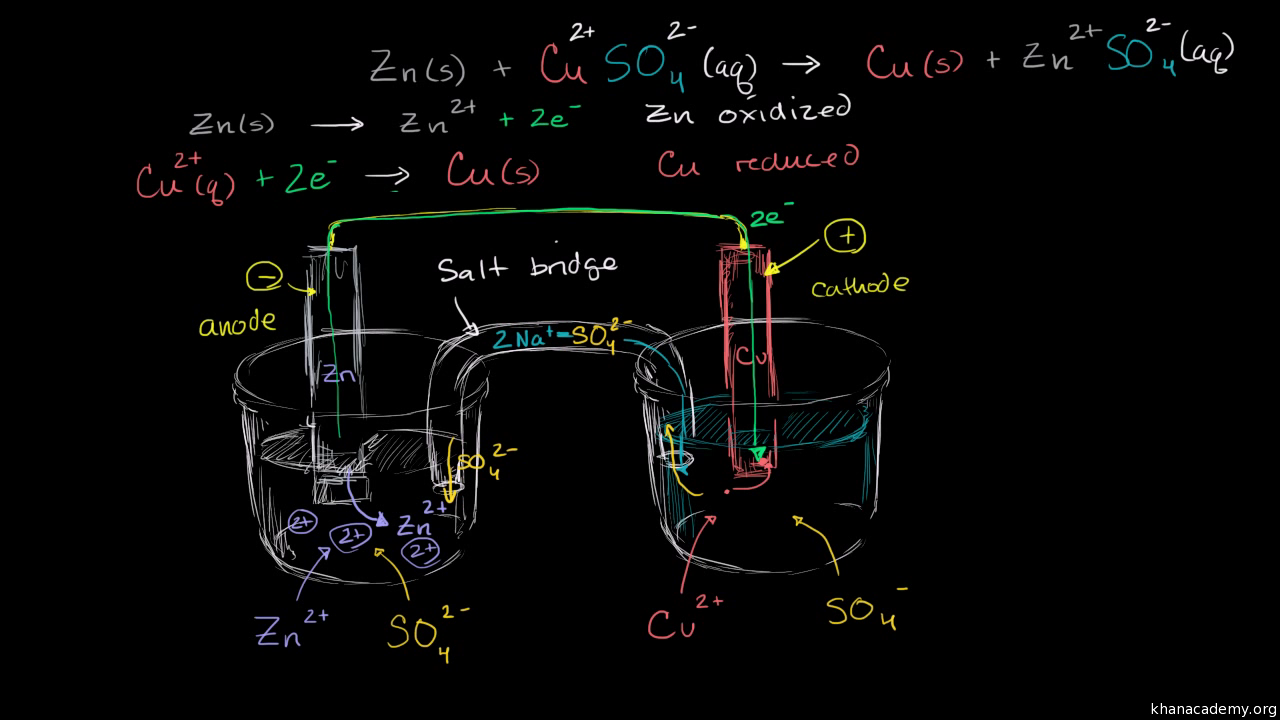
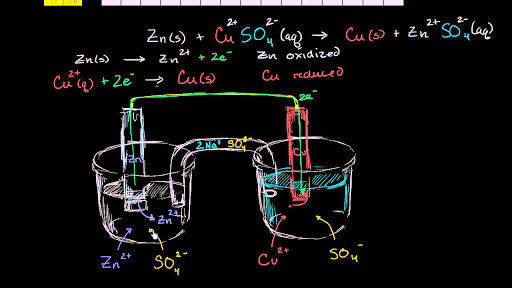
Watch the next lesson. Identifying the half reactions to see what got oxidized and reduced. How to use a redox reaction to construct a galvanicvoltaic cell to produce a flow of current.